Modelo atómico de Niels Bohr

El modelo
atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero
fue el primer modelo atómico en el que se introduce una cuantización a partir
de ciertos postulados (ver abajo). Fue propuesto en 1913 por el físico
danés Niels Bohr, para explicar
cómo los electrones pueden tener órbitas estables alrededor del núcleo y por
qué los átomos presentaban espectros de emisión característicos (dos problemas
que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr
incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
Postulados de
Bohr
En1913, Niels
Bohr desarrolló su célebre modelo atómico de acuerdo
a tres postulados fundamentales.
Primer
postulado
Los electrones describen órbitas circulares en torno al
núcleo del átomo sin radiar energía.
La causa de que el electrón no radie energía en su órbita
es, de momento, un postulado, ya que según la electrodinámica clásica un carga
en movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las
dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la
presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un
sistema no inercual, deben ser iguales en módulo en toda la órbita. Esto nos da
la siguiente expresión:
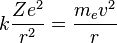
Donde el primer término es la fuerza
eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de
Coulomb, Z es el número atómico del átomo, ees la carga del electrón, me es la masa del electrón, v es la velocidad del electrón en la
órbita y r el radio de la órbita.
Segundo postulado
No todas las órbitas para electrón están permitidas, tan solo se puede
encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón
sea un múltiplo entero de h' = h / 2 π
. Esta
condición matemáticamente se escribe:
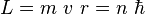
con n = 1, 2, 3, ...
A partir de ésta condición y de la expresión para el
radio obtenida antes, podemos eliminar v y
queda la condición de cuantización para los radios permitidos:

con n = 1, 2, 3, ...
subíndice introducido en esta expresión para
resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que
decía el primer postulado.
Ahora, dándole valores a n,
número cuántico principal, obtenemos los radios de las órbitas permitidas. Al
primero de ellos (con n=1), se le llama radio de Bohr.:

expresando el resultado en angstrom.
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de
una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya
energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley
de Planck tiene una energía:

donde ni identifica
la órbita inicial y nf la
final, y ν es la frecuencia.







